钧慧创新|基于自组装的人源血管化心脏类器官的体内外心脏疾病模拟方法
来源:钧慧管理员 发布时间:2023-09-22
钧慧团队联合华西医院钟治晖教授课题组,在BioRxiv网站上在线发表了最新研究成果的预印本,“ Self-assembly vascularized human cardiac organoids model cardiac diseases in petri dishes and in mice”
(https://doi.org/10.1101/2023.08.26.554935)
在这项研究中,钧慧团队利用小分子化合物调节Wnt/β-catenin信号通路,从人多能干细胞中生成自组装心脏类器官(Cardiac organoids, COs)。由此产生的COs具有多种心脏特异性细胞系和心腔样结构,并在体外表现出自主搏动和血管形成的能力。
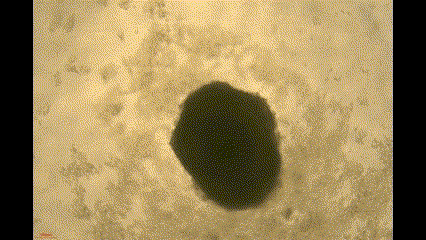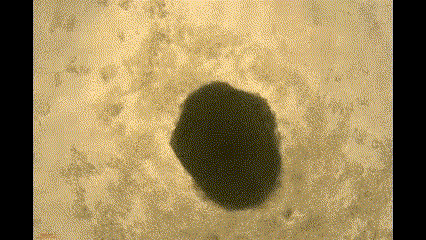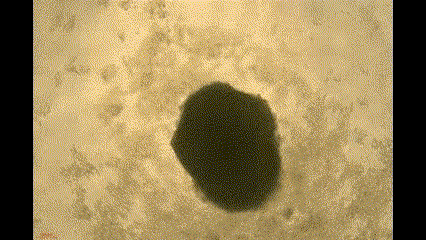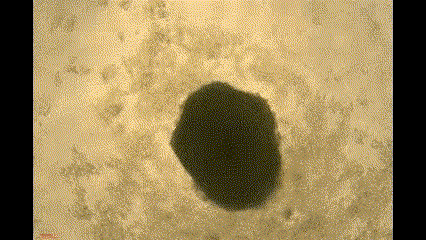
(COs自主搏动)
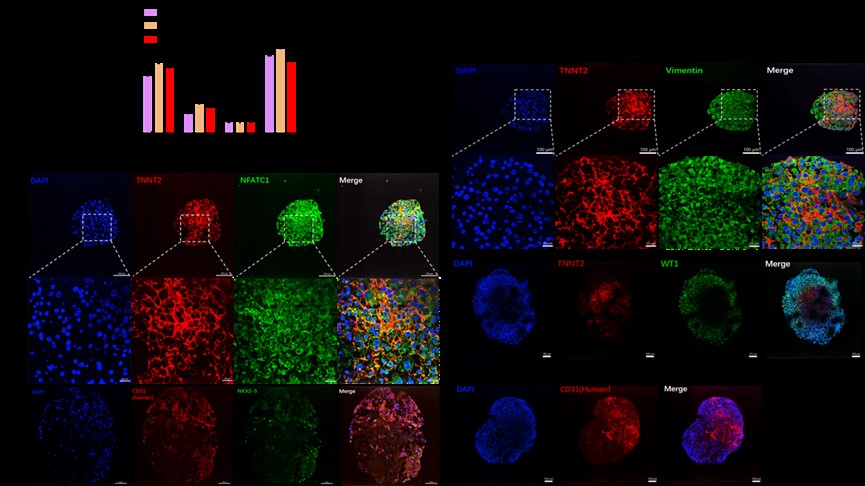
(分化出心外膜等结构)
钧慧团队进一步利用这些复杂且具有功能性的COs来模拟人类心肌梗死模型和SARS-CoV-2刺突蛋白诱导的心肌纤维化模型。无论是体外还是体内模型,均准确地模拟了这些疾病的病理特征。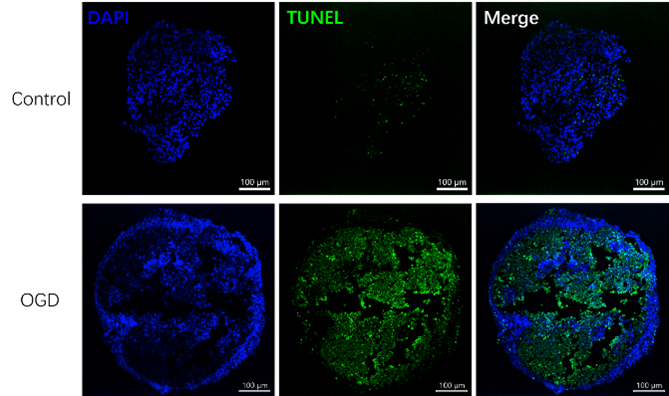
(心肌梗死模型:氧糖剥夺模型COs表现出细胞凋亡的特征)
此外,钧慧团队将COs移植到NOD SCID小鼠中,观察到它们在小鼠体内存活并表现出持续性扩张的特征。在移植75天后,这些COs不仅建立了血管样结构,而且还与宿主小鼠的血管系统相结合;移植后的COs直径发育到8毫米,略大于小鼠心脏的尺寸。这项创新性研究体现了我们体外培养的心脏类器官具有研究心血管疾病的巨大潜力。
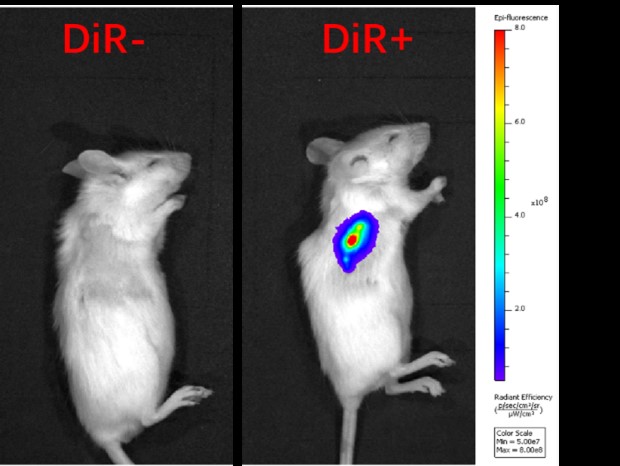
(COs的皮下移植)
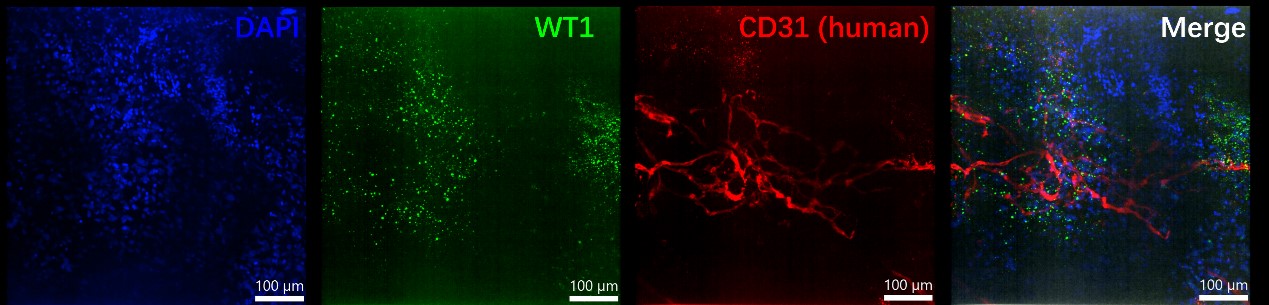
(PT-COs有心外膜标志物(WT1)和血管内皮细胞标志物(CD31)的表达)
人源类器官具有三维结构和细胞内微环境,能很好地模拟人体器官的结构和功能。因此,人源类器官模型已成为研究疾病机制和在临床前研究中进行高通量药物筛选的最佳工具。最近,美国食品及药品管理局(FDA)出台的相关文件表明,在人体试验之前,接受类器官研究的临床前研究结果。
(FDA不再要求药物进行动物试验,类器官迎来契机)
由于人源类器官可以作为临床试验的“零阶段”,能够在Ⅰ期临床试验之前对候选药物进行评估,从而降低成本并节省时间,提高药物开发的整体效率,这为利用人源类器官进行更有效的临床前研究提供了极好的机会。钧慧生物在心血管领域建立了一套全面的临床前药物评价平台,涵盖了从体外类器官模型到大小动物模型的各个环节。这一平台的推出,极大地促进了心血管领域药物在研发过程中的临床转化率。通过更精确地评估候选药物的潜在效果和安全性,研发人员可以更早地筛选出最有希望的候选药物,并将其推向临床试验和市场。这不仅缩短了药物开发周期,还降低了研发成本,从而加速了新药的上市进程。